在制药疫苗的生产中,中间体、起始产品和最终产品必须进行抗原水平测试。它们被测量为丧失活力或减弱的细菌或病毒的数量。总蛋白的分析测量是首选的技术,因为这些抗原通常包括蛋白质。
药典规定列出了几种合适的方法,其中包括许多UV /可见测定(例如洛数,Bradford,BCA测定)和两个总氮技术,其是催化燃烧和KjeldaH1方法。
本文以催化燃烧技术为中心,详细介绍了Pharm。欧元。专题论文2.5.33,方法7b:在氧气气氛中高温热解制NO,然后化学发光检测(CLD)。
该方法的描述几乎与EN 12260重合,概述了TN的测量b通过催化高温燃烧和CLD检测环境水样中形成的NO分子。
这些分析仪可用于确定TNb在药品同时,这也是多N/C分析仪的设计目的。抗原的水平可以通过转换TN来发现b进入总蛋白质。
随着蛋白质中氮的含量不同,通常表明通过将6.25因子相比,将氮总浓度转化为总浓度的蛋白质:C [总蛋白] = C [总氮] x6.25。
欧洲杯足球竞彩材料和方法
仪表
使用多N / C 2100S Pharma进行分析。表1显示了用于测量TOC内容的方法设置。
表格1。方法设置
| 参数 |
Multi N / C 2100s Pharma |
| 测量参数 |
TNb |
| 消化 |
用铂催化剂800℃的高温消化 |
| 单重复次数 |
闵。3,最大。4 |
| 注射前用样品冲洗 |
3倍 |
| 注入量 |
75μl. |
| 稀释 |
1:1 |
样品和试剂
三个未知的客户样本,一个BSA控制标准和五个尿素TNb在客户现场制备的校准标准品进行了三次测定分析。分析前,样品保存在4°C的冰箱中。
将液体样品置于室温条件下,用微管盖住,直接转移至2ml样品瓶中。用自动进样器的微升注射器将75µL的样品分液转移到分析仪的炉中。
在纯氧环境下,利用铂催化剂负载的催化高温燃烧,将所有氮化合物转化为一氧化氮(NO)。
用化学发光检测器(CLD)定量测定NO。测量序列由自动进样器as60辅助,该进样器带有注射器清洗站和采样位置的自动磁力搅拌。
校准
用BSA蛋白标准溶液进行多点校准,以5 ~ 60 mg/L的总结合氮(TN)进行多N/C系统校准b)。BSA的200毫克TN / L储备溶液(Sigma Art.NR.NR.A-7906,牛,白蛋白,具有98%纯度等级和15.60%N含量),其重量为128.2mg,用于100ml超纯水.
通过计算测量的N浓度为6.25的蛋白质浓度来测定分析样品的蛋白质浓度,这是文献中发现这种类型样品的标准转化因子。图1演示了校准曲线。

图1所示。TN - BSA校准曲线的示例和特性范围5 - 60 mg / L N.
结果和讨论
每个样品都已分析至少三次。
表2。液体样品。
| 样本ID. |
平均值
TNb[μg/ ml]±RSD [%]
(1.小瓶) |
平均值
TNb[µgm/L]±RSD [%]
(2.瓶) |
平均值
TNb[μg/ ml]±RSD [%]
(3.小瓶) |
| 10ppm氮标准 |
10.77±0.14 |
10.80±0.51 |
10.74±0.19 |
| 20ppm氮含量 |
20.02±0.20 |
20.05±0.27 |
19.98±0.24 |
| 30 ppm氮标准 |
30.31±0.43 |
30.35±0.28 |
30.42±0.30. |
| 氮标准40ppm |
40.59±0.27 |
40.62±0.42 |
40.65±0.35 |
| 50 ppm氮气std |
50.74±0.11. |
50.96±0.13 |
50.95±0.29 |
| 30 ppm bsa检查std |
30.80±0.54 |
30.89±0.45 |
30.88±0.40 |
| 样本A. |
17.22±0.34 |
17.20±0.52 |
17.18±0.44 |
| 样品B. |
27.95±0.22 |
27.97±0.21 |
27.93±0.40 |
| 样品C. |
48.27±0.34 |
48.25±0.17 |
48.05±0.09 |
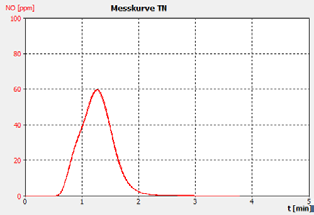
图2a。示例30 PPM BSA检查STD。
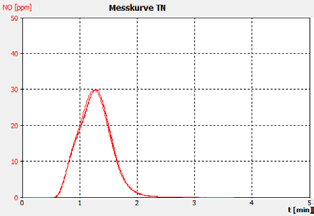
图2b。样本A.
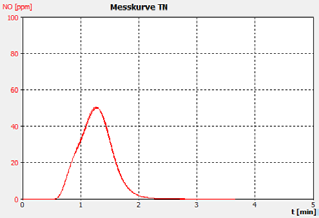
图2C。样品B.
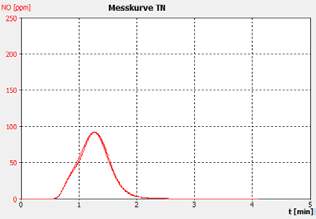
图2D。样品C.
结论
用低RSD和非常高的重复性量化所有样品。使用微透镜注射器的直接喷射系统的独特益处是从小瓶到燃烧炉的直接和有效地传递,而没有长管和阀门。
这使得最大3倍的小冲洗体积为75μL。可以将样品的消耗保持在最低限度。需要小于1.4ml样品,需要进行三个漂洗循环的五个重复,并且代表性注射体积为75μL。
多N / C 2100S Pharma配备了CLD探测器为了测定氮含量是对这些样品进行总蛋白质分析的理想系统,该样品符合Pharm.euR中概述的催化高温消化技术。2.5.33方法7b。
通过示例运行的峰值形状证明了分析仪的性能,这在复制之间表现出没有显着的峰值拖尾或转变,以及客户校准标准解决方案的恢复和检查标准(BSA)。

该信息的来源、审查和改编自美国耶拿分析公司提供的材料。欧洲杯足球竞彩
有关此来源的更多信息,请访问分析耶拿我们。