介绍由于电化学性能非常好,三种过渡金属氧化物,描写2O4,LiCoo.2和Linio.2,已被认为是锂电池中的阴极材料[1-4]。欧洲杯足球竞彩描写2O4是廉价的材料,但其循环性能相当差。吉罗2具有高流动性,但价格昂贵,毒性强。Linio.2由于其大放电容量和低成本(低成本)是一种有前途的阴极材料[1-3]。因此,对该氧化物的制备和表征进行研究具有重要意义。 有几种准备李的方法1 - x倪1 + xO2.它们是固相反应和溶液法[4]。固相反应的化学计量和粒度分布很难控制。因此,有了解决这些问题的方法。本文选择了溶液法之一的溶胶-凝胶法进行研究。与固相反应相比,溶胶-凝胶法具有易于控制化学计量、粒径亚微米、均匀性好等优点。欧洲杯猜球平台此外,该过程使用较短时间和较低的温度[4,5]。该研究的目的是找到李建的最佳条件1 - x倪1 + xO2通过在空气中不同温度和时间的随后煅烧的溶胶 - 凝胶法。确定了最佳工艺条件获得最佳电化学性能的产品。 实验采用类似的方法制备氧化锰锂[6],Li1 - x倪1 + xO2通过羧酸盐前体的混合物使用羧酸锂二水合物和醋酸镍四水合物制备粉末,如图1所示。乙酸锂和乙酸镍溶解在乙醇中,1:1摩尔比。加入乙醇中的草酸,使得酸与总金属摩尔比为1:1。将混合物加热至50-60度oc直到获得干燥的前体。前体在450℃预煅烧o然后在650-800℃的空气中进一步煅烧oc为14-48小时。使用(1)热重分析仪(TGA,Perkin Elmer,Model TGA7)集中分析粉末,加热速度为20oC.Min.-1在氮气氛中,(2)傅立叶变换红外光谱仪(FTIR,Nicolet仪器公司,型号510 FT-IR),KBR作为稀释剂,其范围为400-4,000厘米-1(3) x射线衍射仪(XRD, Siemens, Model D500)工作在20 kV, 15 mA和Cu-Kα作为目标,(4)扫描电子显微镜(SEM,JEOL,Model JSM-840A)在20 kV,(5)原子吸收分光光度计(AAS,Shimazu,Model AA-680)中操作(6)滴定法测定镍和锂的含量3+内容。
|
图1所示。流程图李的准备1 - x倪1 + xO2粉。 |
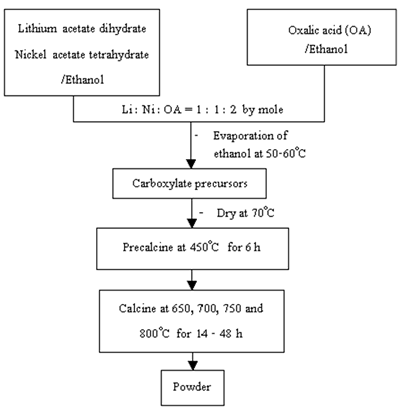
结果和讨论减肥在氮气气氛下研究了羧酸前驱体混合物的TGA,并与草酸、二水乙酸锂和四水乙酸镍进行了比较,如图2所示。
|
图2。(a)草酸,(b)二水合物乙酸锂,(c)四水合物乙酸镍和(d)羧酸前体混合物的TGA。 |
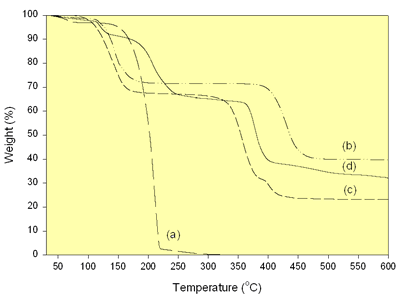
草酸在40-330范围内显示出两个离散的减重区域°C。它们是吸附的水和唯一的草酸在40-150时的蒸发°C和150 - 330°C,分别。在40-228时,由于吸附水和晶格水的蒸发,二水合物乙酸锂有两个失重区°C和醋酸离子在338-470时的分解°C[7]。醋酸镍四水合物显示三种离散的重量损失。它们是吸附和晶格水的蒸发,乙酸盐离子的分解和40-209的残留有机成分°C [7], 271 - 390°C[7]和390 -500°C,分别。在羧酸盐前体的混合物的情况下,由于乙醇的蒸发和40-144的吸附水,存在四个重量损失区域°C,草酸在150-330℃分解°C,醋酸锂和醋酸镍在330-400℃热解时醋酸离子的分解°C和400-600时残留的有机化合物°C。草酸很可能对乙酸盐离子的分解起作用。终止的前体的重量损失,显示锂氧化锂的可能在600处形成°C和更高的温度。 振动焊接前驱体和煅烧后粉体的红外光谱如图3所示。前驱体的光谱显示残留水在2,900-3,700 cm范围内的O-H拉伸-1[8]。结果与前体TGA的重量损失一致,其显示第一区域中水的脱水。与金属离子连接的羧酸盐组的不对称和对称官CoO拉伸为1,610和1,360cm-1分别[8]。游离羧基的缺失表明羧酸中所有的羧基都参与了配位。
|
图3。前体和粉末的FTIR光谱在650-800煅烧oC在空气中为24h。 |
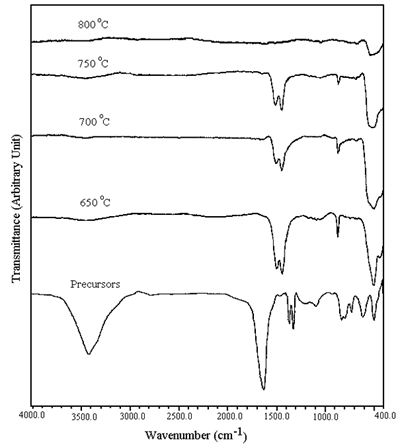
在650-800℃下煅烧的粉末的光谱°C显示O-H拉伸强度的严重降低。未检测到有机化合物的羰基和羧基。CO的拉伸和弯曲带3.2-被检测到1,410-1,510cm-1和880厘米-1分别[8]。CO浓度3.2-随煅烧温度的升高而降低。没有公司3.2-被检测到800°C钙化。根据煅烧过程,在400-600 cm处明显检测到镍氧带-1[9]。 阶段分析粉末在650-800℃煅烧后的XRD谱峰oC在空气中保持24小时如图4所示。在650和700oC,粉末是李1 - x倪1 + xO2(0.≤.x<1)[10-12]含李2倪8O10.[13]和李2有限公司3.[14]作为杂质。非化学计量相和化学计量相的波峰均在同一平面上衍射,均位于相同的2θ,但强度不同[10-13]。750和800oC,只有李1 - x倪1 + xO2被检测到。在650oC,峰宽表明粉末粒度很细。温度越高,粉末晶粒越大,结晶度越高。
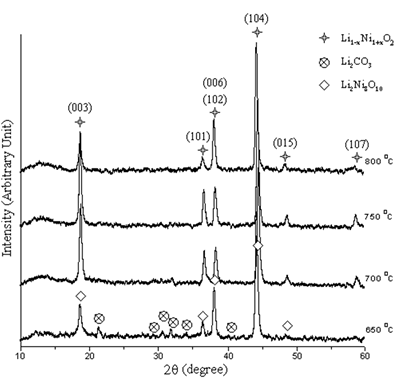
|
图4。粉末的XRD图案在650-800煅烧oC在空气中放置24小时。 |
李的纯化1 - x倪1 + xO2需要少量锂缺乏症。通过强度比I鉴定了制备锂镍氧化镍的最佳条件(003)/一世(104)和我(006 + 102)/一世(101)XRD谱图[4,7,15,16]。粉末的强度比如图5所示。我的最大(003)/一世(104)和最少我(006 + 102)/一世(101)比率是决定氧化物最佳性能的参数[4,7,15,16]。从650-800煅烧的粉末获得的最大和最小强度比oC在空气中24小时的温度为750oC。

|
图5。锂的强度比1 - x倪1 + xO2粉末在650-800煅烧oC在空气中放置24小时。 |
最大强度比对应着锂离子和镍离子的最大有序度。阳离子在其正常晶格位上的驻留将促进载流子的扩散,从而产生良好的电化学性能,如电化学反应[4]的可充电容量和可逆性。最小的强度比对应着最佳的六方有序[15-17],这也是提高电化学性能的关键因素。 可能的形成机制在煅烧过程中,前驱体分解为以下几个步骤:
前体→李1 - x倪1 + xO2(s)+李2倪8O10.(s)+李2有限公司3.(年代) |
(1) |
(1 - x)李2倪8O10.(年代)→2李1 - x倪1 + xO2(s) + (6 -10x) NiO(s) |
(2) |
李2有限公司3.(年代)→李2O (g) +有限公司2(G) |
(3) |
从等式(2)获得的NIO(S)完美的晶格与环境大气中的氧气相互作用,导致NIO(S)含有带负电荷空穴和电子孔的缺乏晶格[18]。环境大气中的氧气吸附在NIO的完美格子上。吸附氧气化学素通过吸引来自Ni的电子2+和镍3+或者形成电子空穴。将化学吸附的氧完全电离形成O.2-另一个洞形成了。同时,Ni2+从普通晶格朝向NIO晶体的表面扩散,以与完全电离的氧离子缔合,并在晶体内带带负电的空位。镍和氧离子占据晶体表面上的正常格子。李+离子(参见公式(3))填充到与Ni相关的带负电荷的空位和电子孔中2+形成倪3+.每一个李+进入这个结构,1个Ni2+被氧化成Ni3+.李的存在+稳定了等量的镍3+或晶体中的电子孔。由于浓度梯度,Li的通量+和镍3+建立了离子。李+和镍3+离子的排列顺序和六方结构的锂1 - x倪1 + xO2最后形成[7,17,19,20]。等式(2)中的NIO分子已加注,将所有物质转化为LI1 - x倪1 + xO2.这个化学反应可以写成 2(1+x) NiO(s) + (1-x) Li2O(g)+ 0.5(1-x)o2(G)→2李1 - x倪1 + xO2(年代)(4) 镍的平均氧化状态镍的总含量(Ni3++ ni2+)和ni.3+使用AAS和滴定确定。倪3+还原为Ni2+用过量的硫酸铁铵和高锰酸钾反滴定。镍在Li中的平均氧化态1 - x倪1 + xO2是用公式计算的吗
平均氧化状态=2 + N.(5) 其中n是ni的摩尔分数3+在镍的总摩尔。镍、锂、镍的含量3+/(倪3++ ni2+)和镍的平均氧化状态如图6和7所示。在650 - 800oC,有两者的存在2+和镍3+.由于LI的蒸发过程增加,镍的含量随着温度的增加而增加2O。随着温度的升高,锂的蒸发速率增加,导致晶体的电化学性能恶化[15,16]。在650 - 750oC,NI3+Ni2+在李2倪8O10.正如前面解释道。还原工艺也建立起来了。氧化过程占主导地位;因此,倪3+增加到750的最大值oC。在800oC,Li.+随着镍的还原,蒸发得很快3+到尼施2+.然后,倪3+内容迅速下降。
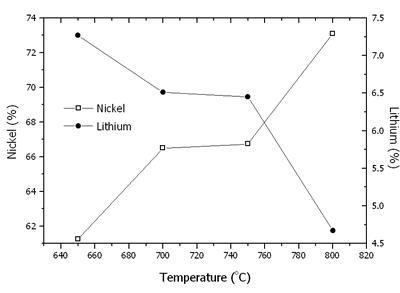
|
图6。锂中镍和锂的含量1 - x倪1 + xO2粉末在650-800煅烧oC在空气中放置24小时。 |
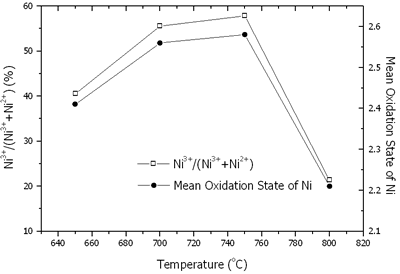
|
图7。NI的内容3+/(倪3++ ni2+)和镍在Li中的平均氧化态1 - x倪1 + xO2粉末在650-800煅烧oC在空气中放置24小时。 |
粉末中镍的平均氧化状态在650-800煅烧oC在空气中24小时是750的最大值oC。结果表明,镍的平均氧化态与最大氧化态具有对应关系3+含量和最佳强度比在相同温度为750oC。 最佳温度和时间什么时候750.oC煅烧保持恒定,时间在14至48小时之间变化,最大和最小强度比图8中示出。最佳煅烧时间为44 h。在最佳温度和时间下,Ni3+镍的含量和平均氧化状态分别为68.33%和2.68。在最佳温度和时间煅烧的粉末的XRD图案如图9所示,由Li组成1 - x倪1 + xO2单相。
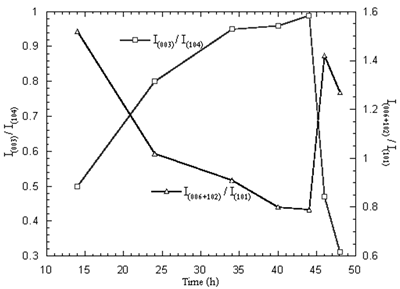
|
图8。锂的强度比1 - x倪1 + xO2在750℃煅烧的粉末o在空气中冷却14-48小时。 |

|
图9。粉体在最佳煅烧温度和时间下的XRD谱图。 |
外部形态李的外部形态1 - x倪1 + xO2用SEM观察粉体在最佳条件下煅烧的情况,如图10所示。粉末由0.3-2组成μ在x射线衍射图谱上显示出良好的结晶性和尖锐的峰。

|
图10。Li的SEM显微照片1 - x倪1 + xO2粉末在最佳温度和时间煅烧。 |
结论李1 - x倪1 + xO2使用草酸作为螯合剂成功制备粉末,作为螯合剂,随后的煅烧在650-800oc为14-48小时。Li的形成机理1 - x倪1 + xO2简单解释如下 前体→李1 - x倪1 + xO2(s)+李2倪8O10.(s)+李2有限公司3.(年代) (1 - x)李2倪8O10.(年代)→2李1 - x倪1 + xO2(s) + (6 -10x) NiO(s) 李2有限公司3.(年代)→李2O (g) +有限公司2(G) 2(1+x) NiO(s) + (1-x) Li2O(g)+ 0.5(1-x)o2(G)→2李1 - x倪1 + xO2(年代) XRD图案显示750和800的锂镍氧化镍的单相oC钙化。我的最大(003)/一世(104)和最少我(006 + 102)/一世(101)强度比,最大Ni3+在750℃时,镍的含量和最大氧化态均存在oC。准备粉末的最佳条件为750oC为44小时。 参考文献1。H. Arai, S. Okada, H. Ohtsuka, M. Ichimura和J. Yamaki,“Li的表征和阴极性能1 - x倪1 + xO2用过量锂法制备固体离子80(1995)261-269。 2。宋明义,李瑞敏,“纳米tio2的制备及电化学性能研究”2锂二次电池正极材料",J.电源,111.(2002) 97 - 103。 3。H. Arai,S. Okada,Y. Sakurai和J. Yamaki,“李的热行为1-Y.NiO2和分解机制“,固态离子。,109.(1998) 295 - 302。 4。“多孔锂离子电池的锂离子插层行为研究”2通过固态反应和溶胶 - 凝胶方法制备的电极“,J.电源,72.(1998) 83 - 90。 5。孙玉康,“尖晶石锂的合成与电化学研究”1.03锰2O4锂二次电池用溶胶欧洲杯足球竞彩-凝胶法制备正极材料100.(1997) 115 - 125。 6。T.Tsumura,S. Kishi,H.Konno,A. Shimizu和M. Inagaki,“锂 - 锰二羧酸酯体系的结构和热分解”,Thermochim。Acta,278.(1996) 135 - 144。 7。李玉生,孙玉刚,南恒,“LiNiO的合成与表征2锂二次电池正极材料的溶胶-凝胶法制备118.(1999) 159 - 168。 8。B.史密斯,“红外光谱解释”,CRC印刷机,N.Y.,(1999)243-249。 9。S. Castro-Garcia, C. Julien和M.A. Senaris-Rodriguez,“通过琥珀酸辅助技术湿化学合成的Li-Ni-Co氧化物的结构和电化学性能”,国际。j . Inorg。板牙。3.(2001) 323 - 329。 10。李文杰,“晶体结构与晶体结构的关系”x倪2 xO2有序-无序跃迁的晶格-气体模型”,Phys。启B,46.(1992) 3236 - 3246。 11.M. M. Rao, C. Liebenow, M. Jayalakshmi, H. Wulff, U. Guth and F. Scholz, " High-temperature Combustion Synthesis and Electrochemical Characterization of LiNiO .2,LiCoo.2和泥2O4锂离子二次电池",J. Solid - State Electrochem.,5(2001) 348 - 354。 12.M. R. Palacin, D. Larcher, A. Audemer, N. Sac-Epee, G.G. Amatucci and J. M. Tarascon,“LiNiO的低温合成2,反应机理,稳定性和电化学性能",J.电化学学报。Soc。144.(1997) 4226 - 4236。 13。J. D. Hanawalt,“1985粉末衍射文件,无机相,搜索手册”,JCPDS国际衍射数据中心,PA 19081,美国,(1985)。 14。S.P. Lin,K.Z.凤,你。HON和M.H.HON,“LINIO的结晶机制2用Pechini法合成”,J.晶体生长,226.(2001)148-157。 15.陈昌华,“合成条件对锂离子电池电化学性能的影响”1-Y.有限公司yO2用于锂电电池的阴极“,J.电源,5059.(2002) 1 - 9。 16。G.T.K.Fy,V.亚克马南诺和J.G。陈,“非化学计量锂镍钴氧化物的合成及其结构和电化学表征”,电影成本。沟通。,3.(2001)234-238。 17。J. N. Reimers,E. Rossen,C.D.琼斯和J.R. Dahn,“李的结构和电化学x菲y倪1-Y.O2,固体离子,61.(1993) 335 - 344。 18。N. Birks和G.H. Meier,“金属高温氧化导论,爱德华·阿诺德”,伦敦(1983)38-40。 19。林世平,冯克志,韩艳明,“结晶动力学与结晶机理”,《中国化学》,第4期x倪2 xO2(0<x≤.1)来自李2有限公司3.和nio“,J.晶体生长,234.(2002) 176 - 183。 20.V. Bianchi, D. Caurant, N. Baffier, C. Belhomme, E. Chappel, G. Chouteau, S. Bach, p . Pereira-Ramos, A. Sulpice and P.Wilmann, " Synthesis, Structural Characterization and Magnetic Properties of quasistochiometric LiNiO .2,固体离子,140.(2001)1-17。 详细联系方式 |