2009年9月14日
十分之一纳米能产生多大的差异?当要弄清楚蛋白质是如何工作的时候,微小的分辨率的提高意味着观察原子的位置和理解它们如何相互作用之间的区别。《自然结构与分子生物学》杂志将于2009年9月13日在网上发表这一新发现,它还提出了锌调节药物的靶点,甚至可能促进对植物叶绿体中类似的锌调节酶的理解,并可能对生物燃料生产产生影响。
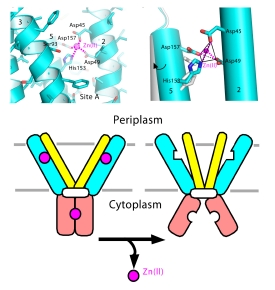
领导这项研究的布鲁克海文生物学家Dax Fu说:“我们的目标是揭示蛋白质结构中的原子相互作用,以理解蛋白质生物学功能的化学基础。”“有了这种结构,我们就可以开始在化学水平上理解锌的运输机制。”
x射线晶体学揭示了该结构布鲁克海文实验室的国家同步加速器光源(NSLS)是一种强x射线、紫外线和红外光的光源。通过研究x射线如何反射晶体蛋白质样品,科学家们可以在三维空间中重建蛋白质原子的位置和方向。
布鲁克海文的研究小组此前曾使用NSLS来解决低分辨率的锌转运蛋白结构。为了实现新的和改进的结构,科学家们添加了汞原子来稳定蛋白质在晶体中的堆积。这使他们的x射线视野的分辨率提高了仅仅1埃(十分之一纳米)。但由于它将蛋白质结构的整体分辨率提高到略低于3埃——这是单个原子开始变得可见的点——这使科学家能够看到蛋白质结合和运输锌离子的活动。
利用荧光探针,科学家们还研究了蛋白质在与锌结合时如何改变形状。他们测试了锌转运蛋白结构元素的变化如何影响其运输锌的能力。
在一起,这些实验表明auto-regulatory锌运输机制:锌结合在细胞内触发hinge-like运动的两个电排斥的部分的蛋白质在细胞的内部,从而导致蛋白质的构象变化部分,穿过细胞膜。所以当细胞内的锌含量过高时,这种形状的改变会以某种方式推动锌离子穿过细胞膜并离开细胞。
“蛋白质究竟是如何推动锌离子通过膜的,还有待确定,”傅说,他补充说,这将是未来研究的重点。
他补充说,可以想象,与蛋白质锌敏感部分结合的药物可以用来调节锌的运输活动,并帮助调节锌的水平,从而可能用于治疗癫痫或糖尿病等疾病。布鲁克海文科学协会(B欧洲杯线上买球rookhaven Science Associates)管理着布鲁克海文实验室(Brookhaven Lab),它已经提交了一份与这项工作相关的专利申请。
此外,由于其他金属转运蛋白与锌转运蛋白具有相似的结构,这项研究的发现可能会促进对其他与金属失衡有关的疾病的理解,以及对这些疾病的可能治疗方法的开发。
此外,这项工作可能会对试图改善植物生物量生产前景的研究人员产生影响,植物是生物燃料发展的重要组成部分。锌在叶绿体(光合作用的场所)的许多反应中是必不可少的辅助因子。但就像动物的情况一样,过量的金属在植物中可能是剧毒的。因此,有助于阐明锌转运蛋白功能的研究可以帮助科学家了解植物如何维持理想生长所需的微妙平衡。
布鲁克海文实验室未来对蛋白质结构的研究有望在2015年一种名为NSLS-II的新光源问世时揭示更多的机理细节。这个正在建设中的设备将比NSLS亮1万倍。提高亮度——因此提高分辨率——在膜蛋白的研究中尤其重要,膜蛋白代表了那些药物开发人员感兴趣的绝大多数蛋白质,但它们通常也很难结晶。
傅说:“这项研究表明,即使是x射线衍射分辨率的微小改进,也能极大地推进我们对蛋白质功能的机制理解。”
本研究是在NSLS的X25A波束上进行的。这项工作得到了美国国立卫生研究院、能源部的科学办公室(基础能源科学办公室)以及布鲁克海文实验室的生物系的支持。欧洲杯线上买球